- Основные характеристики бора
- Физические свойства
- Химические особенности
- Биологическая роль
- Физические свойства
- Изотопы бора
- Влияние бора на организм человека
- Дефицит элемента
- Дополнительные сведения:
- Получение
- Важнейшие соединения:
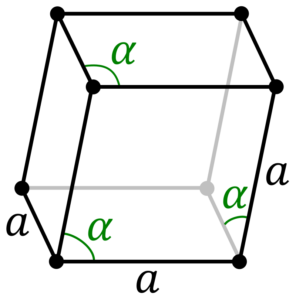
- Кристаллическая решётка бора:
- Описание
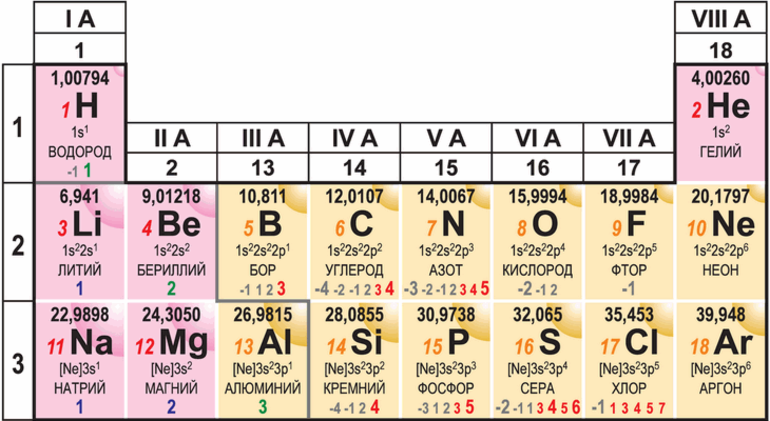
- История и происхождение названия химического элемента Бор
- Применение
- Элементарный бор
- Соединения бора
- Бороводороды и борорганические соединения
- Боразон и его гексагидрид
- Свойства атома бора :
- Общие сведения:
- Нахождение в природе и получение:
- Химические свойства бора:
- Интересные факты об элементе
Основные характеристики бора
Бор принадлежит ко второму периоду, являясь тринадцатым элементом периодической таблицы Менделеева и давая по крайней мере десять аллотропных веществ различных модификаций. Образование этих производных, представляющих собой простые вещества одного элемента, обычно напрямую зависит от температурного режима, при котором был получен сам примитив (в данном случае бор).
Физические свойства
В естественной среде вещество может быть в разных формах, в одном случае полностью пигментированное, в другом сером, красном или темно-коричневом. Структура элемента, который имеет кристаллическую твердую форму или выглядит как конденсат, также может измениться, что указывает на его аморфное состояние. Удивительно, но бор по праву считается одним из самых твердых элементов в мире, уступая только алмазу и многим другим представителям периодической системы.
Что касается его точных характеристик, среди наиболее важных стоит выделить:
- Молярная атомная масса вещества соответствует 10,821 г / моль.
- Радиус атома 98 пм.
- Плотность элемента в нормальных условиях составляет 2,34 грамма на кубический сантиметр.
- Предел прочности на разрыв составляет 5,7 ГПа, что автоматически делает бор абсолютным рекордсменом по этому показателю среди других элементов.
- Температура кипения соответствует 4138 Кельвину, что эквивалентно 3865 градусам Цельсия. При этом сверхтвердый и прочный элемент начинает плавиться только после того, как градусник достигнет 2075 градусов.
- Удельная теплота плавления и испарения составляет соответственно 23,6 и 504,5 кДж / моль.
- Молярная теплоемкость составляет 11,09 Дж / кмоль.
- Молярный объем составляет 4,6 кубических сантиметра на моль.
- Коэффициент теплопроводности вещества соответствует 27,4 Вт / мК.
- Температура Дебая, при которой в рассматриваемом твердом теле возбуждаются все моды колебаний, равна 1250 Кельвину.

Электронная формула бора выглядит так: He 2s22p1. В твердом состоянии вещество образует кристаллическую решетку с ромбоэдрической структурой и значениями a = 10,17 и c = 65,18 A, что дает соотношение 0,576. Несмотря на всю свою твердость, бор является хрупким и широкозонным полупроводником. Это не металл, принадлежащий к группе неметаллов, хотя по основным свойствам бор очень близок к кремнию.
В естественной среде вещество встречается только в виде одного из двух изотопов 10 B и 11 B, при этом количество первого из них составляет 19,8% от общих запасов, а доля второго соответствует показателю из 80,12%. Каждый изотоп имеет свои особенности. Например, первый вариант демонстрирует чрезвычайно высокое эффективное ядерное сечение тепловых (медленных) нейронов, образующих на выходе два нерадиоактивных ядра, характеризующихся очень быстрыми ингибирующими свойствами в естественной среде.
Интересно, что эти два изотопа стабильны, но помимо них существует как минимум 12 изотопных конфигураций со своими валентными и радиоактивными характеристиками. Если рассматривать самую длинную производную, то это, несомненно, 8 В, период полураспада которых составляет 0,77 секунды.
Химические особенности
Название бора в периодической таблице состоит из одной латинской буквы B. Специалисты подчеркивают особую инертность этого элемента, так что в нормальной окружающей среде он может вступать в прямое химическое взаимодействие только с таким веществом, как фтор. Если его нагреть, на выходе могут быть получены различные производные триагалогенида, начиная с нитрида бора, который образуется при соединении с азотом, и заканчивая фосфидом BP, который получается при взаимодействии с фосфором.
При использовании углерода получаются смеси карбидов, которые имеют различный состав и свойства. В открытом пространстве нагревание приводит к тому, что вещество быстро сгорает, выделяя большое количество тепловой энергии и образуя оксид B2O3, точное определение которого — ангидрид борной кислоты. Что касается водорода, то считается, что бор не может вступить с ним в прямой контакт, хотя науке известно довольно внушительное количество всех типов борогидридов, образующихся при обработке боридов щелочных металлов кислотными соединениями.
Если прибегнуть к сильному нагреву, можно провести довольно интересный эксперимент, демонстрирующий восстановительные свойства вещества, с помощью которого будет вполне реально выделить кремний, фосфор и другие элементы из их оксидных соединений. Следует отметить, что при отсутствии в среде окислителей бор становится устойчивым к действию различных щелочных соединений. В то же время он свободно растворяется в гидроксидах, смешанных с нитратом калия.
Среди других параметров химической составляющей элемента стоит упомянуть:
- Ковалентный радиус бора составляет 82 пм.
- Радиус иона соответствует 23 пм с максимальной погрешностью до +3e.
- Индекс электроотрицательности составил 2,04 усл. Ед. По шкале Полинга.
- Степени окисления химического элемента -3 / 0 / + 3.
- Энергия ионизации в первом электроне составляет 800,2 кДж / моль.

На бор влияет теплая азотная среда, а также его растворение в серной кислоте или смеси концентрированных кислот, называемых царской водкой, что приводит к образованию борной кислоты, часто используемой в медицине. Этот же компонент обычно содержится в любом оксиде бора с возможностью высвобождения при взаимодействии с водой.
Если прибегнуть к сочетанию бора с различными щелочами, то на выходе можно будет получить соли (тетрабораты), которые не следует путать с обычными боратами, являющимися солями борной кислоты. По общему признанию, химические свойства этого элемента еще полностью не изучены, и каждый год исследователи делают новые открытия. Например, в 2014 году немецким специалистам удалось разработать и распространить уникальную двухцентровую связь двухэлектродного типа, создание которой стало возможным благодаря взаимодействию атомов бора и бериллия.
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизни растений. Недостаток бора останавливает их развитие и вызывает различные заболевания культурных растений. В основе этого нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При недостатке бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожайность, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в организме животных не выяснена. В мышечной ткани человека содержится (0,33-1) • 10–4% бора, в костной ткани (1,1–3,3) • 10–4%, в крови — 0,13 мг / л. Человек получает 1-3 мг бора в сутки с пищей. Токсическая доза — 4 г.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-носитель, который предположительно регулирует внутриклеточную концентрацию бора.
Бор, Борум, Б (5)
Природные соединения бора (Boron, French Vogue, German Bor), в основном нечистая бора, известны с раннего средневековья. Под названиями Тинкал, Тинкар или Аттинкар (Тинкал, Тинкар, Аттинкар) бур был завезен в Европу из Тибета; его использовали для сварки металлов, особенно золота и серебра. В Европе тинкал часто называли Боракс (Borax) от арабского слова bauraq и персидского слова burah. Иногда бура или борако обозначали различные вещества, например соду (нитрон). Руланд (1612) называет бура хризоколла, смолой, способной «склеивать» золото и серебро. Лемери (1698) также называет бура «клеем золота» (Auricolla, Chrisocolla, Gluten auri). Иногда borax означало что-то вроде «золотой уздечки» (capistrum auri). В эллинистической и византийской химической литературе Александрии борах и борахон, а также по-арабски (баурак) обычно обозначали щелочь, например, баурак арман (армянский борак), или сода, позже так стали называть бура.
В 1702 году Хомберг, прокаливая буру с сульфатом железа, получил «соль» (борную кислоту), которую назвали «седативной солью Гомберга» (Sal sedativum Hombergii); эта соль нашла широкое применение в медицине. В 1747 году барон синтезировал буру из «успокаивающей соли» и натрона (соды). Однако состав буры и «соли» оставался неизвестным до начала 19 века. В «Химической номенклатуре» 1787 г фигурирует название horacique asid (борная кислота). Лавуазье в «Таблице простых тел» приводит (радикальный борацик). В 1808 г. Гей-Люссак и Тенар сумели выделить свободный бор из борного ангидрида путем нагревания последнего с металлическим калием в медной трубке; предложили назвать элемент бором (Вога) или бором (Вога). Дэви, повторивший эксперименты Гей-Люссака и Тенара, также получил свободный бор и назвал его борацием. Позже англичане сократили это название до Boron. В русской литературе слово бора встречается в рецептурных сборниках XVII — XVIII веков. В начале 19 века. Русские химики называли бор бором (Захаров, 1810), буро (Страхов, 1825), борной кислотой, бурацином (Севергин, 1815), бором (Двагубский, 1824). Переводчик книги Гизе назвал бор штормом (1813 г.). Также встречаются названия борита, борона, буронита и др.
Физические свойства
Сечения захвата нейтронов изотопами 10B (верхняя кривая) и 11B (нижняя кривая).
Чрезвычайно твердое вещество (уступающее только алмазу, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
Бор имеет самый высокий предел прочности на разрыв 5,7 ГПа.
Изотопы бора
Основная статья: изотопы бора
Бор встречается в природе в виде двух изотопов 10B (19,8%) и 11B (80,2 %).
10B имеет очень высокое сечение захвата тепловых нейтронов, равное 3837 барн (для большинства нуклидов это сечение близко к единицам или долям сарая), а когда нейтрон захватывается, два нерадиоактивных ядра (альфа-частицы и литий-7) очень быстро тормозятся в среде, при этом проникающее излучение (гамма-кванты) отсутствует, в отличие от аналогичных реакций захвата нейтронов другими нуклидами:
10B + n → 11B * → α + 7Li + 2.31 МэВ.
Поэтому 10B в борной кислоте и других химических соединениях используется в ядерных реакторах для контроля реактивности, а также для биологической защиты от тепловых нейтронов. Кроме того, бор используется в нейтронно-захватной терапии рака.
Помимо двух стабильных известно 12 других радиоактивных изотопов бора, из которых наиболее долгоживущим является 8B с периодом полураспада 0,77 с.
Влияние бора на организм человека
Функции и влияние, которое бор оказывает на человеческий организм, имеют первостепенное значение. Его основная концентрация находится в костной ткани и зубной эмали. Огромное количество бора сосредоточено в плазменной части крови новорожденных, но масса элемента исчезает очень быстро через несколько дней. В небольшом количестве этот элемент содержится в яичках мужчин, печени, тканях почек и легких, лимфатических узлах, мозговой и мышечной ткани.
Благодаря бору происходит естественная и правильная деятельность желез эндокринной системы, а в организм лучше усваиваются полезные вещества в виде кальция, магния и фтора, которые играют ведущую биологическую роль в формировании костной ткани, улучшение и, таким образом, укрепление прочности скелетной структуры.
При достаточном составе бора в организме мужчины и женщины повышается гормональный фон, что особенно важно в период возрастной физиологии у женщин. Холекальциферол синтезируется с бором, в результате чего происходит более продуктивное всасывание кальция. Можно сказать, что бор отлично влияет на формирование и укрепление костной ткани. А в сочетании с витаминно-минеральным комплексом и некоторыми лекарствами бор оказывает положительное влияние при лечении опорно-двигательного аппарата.
Элементы бора нормализуют активацию ферментов нуклеиновых кислот, тем самым также участвуя в образовании. Благодаря борным соединениям белки и клетки тканей правильно формируются, растут и обновляются.
Полезные свойства бора направлены на уменьшение ксалатов, которые взаимодействуют с кальцием и превращаются в камни, откладывающиеся в почках.
Польза бора влияет на многие жизненно важные функции человеческого организма:
- структура хрящевой и костной ткани правильно сгруппирована, чтобы избежать артрита, остеопороза, артроза;
- улучшает обмен веществ и минералов: кальция, магния, фтора, цинка, фосфора;
- регулируются процессы желез эндокринной системы;
- витамин D превращается в идеальную для усвоения форму;
- нормализуется выработка нуклеотидов;
- стимулируется синтез белков и полипептидов, которые участвуют в обновлении всех клеток;
- улучшается и стабилизируется работа головного мозга и нервной системы;
- повышает активность мужских и женских гормонов;
- самочувствие стабилизируется в период климакса у женской половины;
- помощь в производстве и регулировании ферментов;
- профилактика некоторых заболеваний позвоночника;
- регулирование обмена веществ;
- профилактика развития камней в почках.
Микрочастицы бора, как мы видим, оказывают мощное воздействие на организм. © https://ydoo.info/micro/bor.html Но поскольку элемент был открыт и получен относительно недавно, ученые еще не до конца поняли роль материи в жизни человека.
Дефицит элемента
Что касается дефицита этого микроэлемента, то он встречается крайне редко, но это явление еще полностью не изучено. Основные исследования в основном проводились на цыплятах, но даже тогда они показали, что недостаток этого химического элемента может вызвать задержку роста.
Некоторым ученым удалось объяснить проявления дефицита бора и выяснить, с чем они могут быть связаны. Так, при острой нехватке вещества может нарушиться работа желез нейроэндокринной системы, вызвав дисбаланс гормонального фона. Это, в свою очередь, может быть тесно связано с нездоровым состоянием женского организма, в результате которого развиваются миома, эктопия, фиброзно-кистозная болезнь, поликистоз яичников и рак. Недостаток бора увеличивает риск снижения плотности костей, возникновения почечной и мочекаменной болезни и заболеваний суставов.
Дефицит микроэлемента также влияет на нервную структуру и деятельность мозга. Недостаточное количество отрицательно влияет на мыслительные процессы, концентрацию, реакцию и концентрацию. Ученым удается зафиксировать эти проявления исключительно с помощью устройства, считывающего работу мозга.
Первоначально симптомы нехватки вещества могут быть похожи на простой гиповитаминоз: наслоение ногтевой пластины, дряблость эпидермиса, тусклость линии роста волос, сонливость, легкое головокружение.
Дополнительные сведения:
| 900 | Дополнительная информация | |
| 901 | Количество CAS | 7440-42-8 |
Получение
- Наиболее чистый бор получается пиролизом борогидридов. Этот бор используется для производства полупроводниковых материалов и тонкого химического синтеза.
B2H6 → т 2B + 3H2
- Металлотермический метод (чаще всего восстановление магнием или натрием):
B2O3 + 3Mg ⟶ 3MgO + 2B KBF4 + 3Na ⟶ 3NaF + KF + B
- Термическое разложение паров бромида бора на горячей вольфрамовой проволоке (1000-1200 ° C) в присутствии водорода (метод Ван Аркеля):
2BBr3 + 3H2 → W 2B + 6HBr
Важнейшие соединения:
Оксид бора, B2O3 — бесцветная стекловидная масса, кислотный оксид, реагирует с водой с образованием сначала мета-, затем ортоборной кислоты. При плавлении с оксидами металлов образует бораты.
Борная кислота — H3BO3 — (ортоборная) — бесцветные кристаллы, очень слабый одноосновный a-che, для равновесия в растворе: H3BO3 + H2O <=> H + + B (OH) 4-
При реакции со щелочью образует соли полиборных кислот (обычно тетрабораты) или метаболические:
4H3BO3 + 2NaOH = Na2B4O7 + 7H2O; H3BO3 + NaOH = NaBO2 + 2H2O.
При нагревании теряет воду, превращаясь в метаболические кислоты (HBO2), затем в тетраборные кислоты (H2B4O7) и, как следствие, в оксид бора.
Реагирует со спиртами в присутствии концентрированной серной кислоты с образованием легколетучих сложных эфиров:
H3BO3 + 3 С2H5OH = B (OC2H5) 3 + 3Н2О
При воспламенении эти эфиры горят зеленым пламенем, что является качественной реакцией на соли борной кислоты.
Тетраборат натрия Na2B4O7 — (безводная бура), Na2B4O7 * 5H2O (бура для ювелирных изделий) Na2B4O7 * 10H2O (бура) бесцветные кристаллические вещества, растворяются в воде, образуя при гидролизе сильно щелочной раствор. При сплавлении с оксидами многих металлов образует метаборатное стекло с характерными цветами, которые используются при анализе: Na2B4O7 + CoO = 2NaBO2 + Co (BO2) 2 (синий)
Пероксобат натрия Na B2 (O2) 2 (OH) 4 2 (перборат). Окисляющий агент за счет перекисных мостиков, активный ингредиент отбеливателей, «не содержащий хлора» («персил», «персол» и т.д.).
Боргидриды BxHy, (бораны): соединения бора с водородом, ядовитые вещества с неприятным запахом: B2H6 и B4H10 — газ, B5H9 — жидкость, B10H14 тв. Другой. Получается реакцией боридов с кислотами, например:
Mg3B2 + 6HCl = B2H6 + 3MgCl2
Способен самовозгораться на воздухе и гореть с выделением большого количества энергии
Кристаллическая решётка бора:
| 500 | Кристаллическая решетка | |
| 511 | Кристаллическая решетка # 1 | α-R-бор |
| 512 | Ретикулярная структура | Ромбоэдрический (тригональный)
|
| 513 | Параметры решетки | а = 10,92, а = 23,81° |
| 514 | C / a отчет | |
| 515 | Температура Дебая | 1250 К |
| 516 | Название группы пространств симметрии | R_ 3м |
| 517 | Номер пространственной группы симметрии | 166 |
| 521 | Кристаллическая решетка # 2 | β-R-бор |
| 522 | Ретикулярная структура | Ромбоэдрический (тригональный)
|
| 523 | Параметры решетки | а = 10,17, а = 65,18° |
| 524 | C / a отчет | |
| 525 | Температура Дебая | |
| 526 | Название группы пространств симметрии | R_ 3м |
| 527 | Номер пространственной группы симметрии | 166 |
Описание
Бор до 1980 года считался второстепенным элементом, который вообще не использовался в рационе. Но в 1985 году ученые установили факт, перевернувший представление об этом веществе с ног на голову. Изначально эксперименты проводились на птицах и цыплятах, и те, кто получил химический элемент с пищей, развивались быстрее и были здоровее. И уже в 90-х годах ХХ века бор окончательно стал считаться ценным и полезным веществом.
Впервые вещество было получено в начале 1800-х годов французскими химиками Гей-Люссаком и Тенаром. Элемент был назван в честь древних арабских и персидских имен Бора.
В элементарной форме вещество не встречается, но входит в состав природных минералов боратной группы. Бор практически не встречается в чужеродных минералах. Элемент содержится в земной коре, в море, в соленых озерах, в термальных источниках, в грязевых вулканах.
История и происхождение названия химического элемента Бор
Впервые он был получен в 1808 г французскими физиками Ж. Гей-Люссаком и Л. Тенаром при нагревании диоксида бора B2O3 с металлическим калием. Через несколько месяцев Х. Дэви получил бор электролизом расплавленного B2O3.
Применение
Элементарный бор
Бор (в виде волокон) действует как упрочняющий агент во многих композитах.
Бор также часто используется в электронике в качестве акцепторной добавки для изменения типа проводимости кремния.
Бор используется в металлургии как элемент микролегирования, значительно повышающий закаливаемость сталей.
Бор также используется в медицине для борной нейтронно-захватной терапии (метод избирательного воздействия на клетки злокачественных опухолей).
Соединения бора
Карбид бора используется в компактной форме для производства динамических газовых подшипников.
Пербораты / пероксобораты (содержащие ион B2 (O2) 2 (OH) 4 2-) B4O12H8 -) используются в качестве окислителей. Технический продукт содержит до 10,4% «активного кислорода»; на его основе выпускаются отбеливатели, не содержащие хлора («персил», «персол» и др.).
Отдельно стоит отметить, что сплавы бор-углерод-кремний обладают очень высокой твердостью и могут заменить любой абразивный материал (кроме алмаза, нитрида бора по микротвердости), а также превосходят все известные человечеству абразивные материалы по стоимости и эффективности ректификации (эконом.
Сплав бора с магнием (диборид магния MgB2) в настоящее время имеет рекордно высокую критическую температуру перехода в сверхпроводящее состояние между сверхпроводниками первого типа. Появление вышеупомянутой статьи стимулировало значительный рост работы по этой теме.
Борная кислота (B (OH) 3) широко используется в ядерной технике в качестве поглотителя нейтронов в ядерных реакторах (PWR) типа ВВЭР, использующих «тепловые» («медленные») нейтроны. Благодаря своим физико-нейтральным характеристикам и способности растворяться в воде использование борной кислоты позволяет равномерно (а не постепенно) регулировать мощность ядерного реактора путем изменения ее концентрации в теплоносителе — так называемое «борное регулирование».
Борная кислота также используется в медицине и ветеринарии.
Нитрид бора, активированный углеродом, представляет собой фосфор со свечением от синего до желтого под воздействием ультрафиолетового излучения. Обладает независимой фосфоресценцией в темноте и активируется органическими веществами при нагревании до 1000 ° C.Производство люминофоров из нитрида бора состава BN / C не имеет промышленного назначения, но широко практиковалось химиками-любителями в первой половине XX века. 20 век.
Боросиликатное стекло — это стекло обычного состава, в котором щелочные компоненты в сырье заменены оксидом бора (B2O3).
Фторид бора BF3 в нормальных условиях представляет собой газообразное вещество, используется в качестве катализатора в органическом синтезе, а также в качестве рабочего тела в газонаполненных детекторах тепловых нейтронов за счет захвата нейтронов бором-10 с образованием лития-7 и гелия-7. 4 ядра, ионизирующие газ (см. Реакцию выше).
Бороводороды и борорганические соединения
Ряд производных бора (боргидриды) являются эффективными пропеллентами (диборан B2H6, пентаборан, тетраборан и т.д.), А некоторые полимерные соединения бора с водородом и углеродом устойчивы к химическому воздействию и высоким температурам (например, хорошо известный пластик Carborano-22).
Боразон и его гексагидрид
Нитрид бора (боразон) похож (по электронному составу) на углерод. На основе образуется большая группа соединений, в чем-то похожих на органические.
Так, гексагидрид боразона (H3BNH3, близкий по структуре к этану) в нормальных условиях представляет собой твердое соединение с плотностью 0,78 г / см3, содержит почти 20% водорода по массе. Его можно использовать в водородных топливных элементах для питания электромобилей.
Свойства атома бора :
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 10,806-10,821 а.е.м. (г / моль) |
| 202 | Электронная конфигурация | 1с2 2с2 2п1 |
| 203 | Электронная оболочка | K2 L3 M0 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (рассчитанный) | 84 вечера |
| 205 | Эмпирический радиус атома* | 85 часов |
| 206 | Ковалентный радиус* | 82 вечера |
| 207 | Ионный радиус (кристаллический) | B3+
25 (16) вечера, 41 (6) вечера (в скобках указано координационное число — характеристика, определяющая количество ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 192 вечера |
| 209 | Электроны, протоны, нейтроны | 5 электронов, 5 протонов, 6 нейтронов |
| 210 | Семья (блок) | член семьи p |
| 211 | Период в периодической таблице | 2 |
| 212 | Группа по периодической таблице | 13 группа (по старой классификации — основная подгруппа 3 группы) |
| 213 | Спектр излучения |  |
Общие сведения:
| 100 | Общий* | |
| 101 | Имя | Бор |
| 102 | Прежнее название | |
| 103 | Латинское название | Borum |
| 104 | Английское имя | Бор |
| 105 | Условное обозначение | Б |
| 106 | Атомный номер (номер в таблице) | 5 |
| 107 | Вид | Неметалл |
| 108 | Группа | |
| 109 | Открытым | Жозеф Луи Гей-Люссак и Луи Жак Тенар, Франция, 30 июня 1808 г., Хамфри Дэви, Великобритания, 9 июля 1808 г |
| 110 | Год открытия | 1808 г. |
| 111 | Внешний вид и др. | Бесцветные, темно-серые, темно-коричневые, темно-красные или коричневые кристаллы. Либо темно-серая, либо черная аморфная субстанция |
| 112 | Источник | Натуральный материал |
| 113 | Изменения | |
| 114 | Аллотропные модификации | Более 10 аллотропных модификаций бора, в том числе.:
— α-R-бор (B12) с ромбоэдрической (тригональной) кристаллической решеткой и 12 атомами в элементарной ячейке, — β-R-бор с ромбоэдрической (тригональной) кристаллической решеткой и ~ 105 атомов на элементарную ячейку, — α-T-бор ((B12) 4B2) с тетрагональной кристаллической решеткой и 50 атомами на элементарную ячейку, — β-Т-бор с тетрагональной кристаллической решеткой, — γ-бор с ромбической кристаллической решеткой и 28 атомами в элементарной ячейке, — сверхпроводящий бор с неизвестной кристаллической решеткой. Большинство аллотропных модификаций бора основаны на икосаэдрических мотивах B12 |
| 115 | Температурные и другие условия перехода аллотропных модификаций друг в друга | α-R-бор, β-R-бор, α-T-бор и β-T-бор существуют в нормальных условиях окружающей среды.
γ-бор получают путем сжатия других аллотропных модификаций бора до 12-20 ГПа и нагревания до 1500-1800 ° C. -бор остается стабильным после снижения температуры и давления. α-T-бор и β-T-бор получают сжатием других аллотропных модификаций бора до 12-20 ГПа и нагреванием до 1800-2200 ° C. Сверхпроводящий бор с неизвестной кристаллической решеткой получается путем сжатия других аллотропных модификаций бора выше 160 ГПа и существует в этих условиях. |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | 2D материалы | Борофен |
| 118 | Содержание в атмосфере и воздухе (по весу) | 0 % |
| 119 | Содержится в земной коре (по массе) | 0,00086 % |
| 120 | Содержится в морях и океанах (по массе) | 0,00044 % |
| 121 | Содержится во вселенной и пространстве (по массе) | 1,0 10-7 % |
| 122 | Содержание в Солнце (по массе) | 2,0 10-7 % |
| 123 | Содержание метеорита (по массе) | 0,00016 % |
| 124 | Содержание в организме человека (по весу) | 0,00007 % |
Нахождение в природе и получение:
Природный бор состоит из двух стабильных изотопов: 10B (18,9%) и 11B (81,1%).
Содержание бора в земной коре 1 · 10-3% по массе (28 место), в водах Мирового океана 4,4 · 10-4% (4,4 мг / л). В воде и донных отложениях некоторых озер (особенно горьких) содержание бора выше. Наиболее важными минералами являются, например, боросиликаты данбурит CaB2Si2O8, бура — Na2B4O7 · 10H2O, тетраборат натрия, кернит — Na2B4O7 · 4H2O, сассолин (борная кислота) — H3BO3.
Борный ангидрид или тетраборат натрия получают из природных минералов, которые затем восстанавливаются металлотермическим способом: B2O3 + 3Mg = 3MgO + 2B или 2Na2B4O7 + 3Na = B + 7NaBO2.
Бор высокой чистоты, необходимый для производства полупроводников, получают пиролизом борогидридов (B2H6) или разложением бромида бора на горячей вольфрамовой проволоке (1000-1200 ° C) в присутствии водорода. 2BBr3 + 3H2 = 2B + 3HBr.
Химические свойства бора:
| 300 | Химические свойства | |
| 301 | Состояния окисления | -1, 0, +1, +2, +3 |
| 302 | Валентность | III |
| 303 | Электроотрицательность | 2,04 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 800,64 кДж / моль (8,298019 (3) эВ) |
| 305 | Электродный потенциал | |
| 306 | Энергия сродства атома к электрону | 26,989 (3) кДж / моль (0,279723 (25) эВ) |
Интересные факты об элементе
Первыми учеными, которым удалось получить бор в чистом виде, были знаменитые французские химики, которых когда-то звали Жозеф Луи Гей-Люссак и Луи Жак Тенар. Это знаменательное событие произошло в 1808 году при нагревании борной кислоты металлическим калием. Всего несколько месяцев спустя такое же открытие было совершено другим светилом, Хамфри Дэви из Великобритании, который смог удалить бор электролизом предварительно плавленого бесцветного ангидрита.